發(fā)布時間:2021-06-28
6月28日,《神經(jīng)元》期刊在線發(fā)表了題為《人源GluN1-GluN2A NMDA受體的門控機制和一個全新小分子結(jié)合位點》的研究性論文,該研究由中國科學(xué)院腦科學(xué)與智能技術(shù)卓越創(chuàng)新中心(神經(jīng)科學(xué)研究所)、神經(jīng)科學(xué)國家重點實驗室、上海腦科學(xué)與類腦研究中心的竺淑佳研究組完成。該研究解析了一系列人源NMDA(N-methyl-D-aspartic acid,即N-甲基-D-天冬氨酸)受體GluN1-GluN2A亞型與不同小分子化合物結(jié)合的高分辨率冷凍電鏡的結(jié)構(gòu),并探究了受體在不同小分子結(jié)合下的門控機制,同時也發(fā)現(xiàn)了一個全新的小分子結(jié)合位點。該研究豐富了NMDA受體的神經(jīng)藥理學(xué)特性,為深入理解NMDA受體結(jié)構(gòu)和功能之間的聯(lián)系提供了新的分子機制。

NMDA受體作為一類重要的興奮性離子型谷氨酸受體,在神經(jīng)系統(tǒng)發(fā)育形成與突觸可塑性中發(fā)揮重要功能。NMDA受體通常由兩個結(jié)合甘氨酸的必需亞基GluN1和兩個結(jié)合谷氨酸的可變GluN2亞基(2A-2D)組成異源四聚體離子通道蛋白。其功能異常與中樞神經(jīng)系統(tǒng)和精神疾病(如抑郁癥、精神分裂癥、帕金森病和阿爾茲海默癥等)有密切的關(guān)聯(lián)性。這些神經(jīng)和精神疾病給患者及病人家屬帶來極大的痛苦,是亟需解決的重要臨床難題。因此,深入研究NMDA受體在生理狀態(tài)下的構(gòu)象與功能,并揭示全新的小分子結(jié)合位點,對于靶向NMDA受體功能異常的新藥研發(fā)是至關(guān)重要的。
本研究通過冷凍電鏡解析了一系列高分辨率的處于不同生理狀態(tài)下GluN1-GluN2A NMDA受體結(jié)構(gòu)(下圖)。首先,研究者引入一對半胱氨酸交聯(lián),使受體處于更激活狀態(tài),并發(fā)現(xiàn)GluN1亞基和GluN2A亞基的配體結(jié)合域二聚體有向內(nèi)旋轉(zhuǎn)的構(gòu)象變化,驗證了之前的功能及動力學(xué)模擬研究。
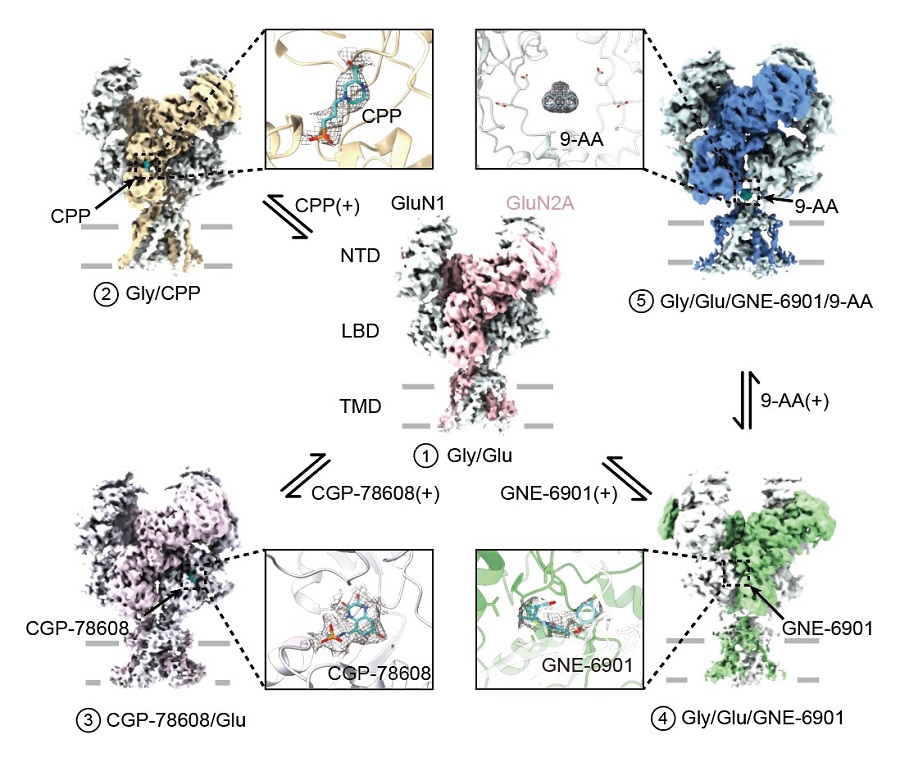
圖1 | 冷凍電鏡解析不同狀態(tài)下人源GluN1-GluN2A NMDA受體
同時,研究人員分別使用高親和力的GluN2A亞基的競爭性抑制劑CPP和GluN1亞基的競爭性抑制劑CGP-78608來模擬的受體抑制關(guān)閉的狀態(tài)。與激動劑結(jié)合的受體結(jié)構(gòu)對比發(fā)現(xiàn),配體結(jié)合域整體處于被打開的構(gòu)象。隨著配體結(jié)合域的構(gòu)象打開,鉸鏈區(qū)失去對門控通道結(jié)構(gòu)域的牽引,進而使得門控通道處于關(guān)閉狀態(tài)。為研究變構(gòu)調(diào)節(jié)機制,研究人員進一步使用GluN2A亞基特異的正性變構(gòu)調(diào)節(jié)劑GNE-6901與GluN1-GluN2A蛋白結(jié)合。之前的研究發(fā)現(xiàn)該小分子通過作用在由GluN2A亞基組成的NMDA受體上,可以促進CA1錐體神經(jīng)元的興奮性突觸后電位進而改善腦部功能。冷凍電鏡解析的GNE-6901結(jié)合的NMDA受體結(jié)構(gòu)分析發(fā)現(xiàn),小分子結(jié)合在GluN1與GluN2A亞基配體結(jié)合域間二聚體中引起構(gòu)象變化,使得受體的門控通道進一步處于相對開放的構(gòu)象。
最后,研究人員在NMDA受體上首次發(fā)現(xiàn)一個全新的小分子結(jié)合位點。研究人員使用開放通道抑制劑9-AA與受體結(jié)合并解析了三維結(jié)構(gòu),發(fā)現(xiàn)9-AA小分子處于受體跨膜區(qū)門控通道的連接域處,完全不同與此前功能實驗預(yù)測的傳統(tǒng)通道抑制劑結(jié)合位點。為了驗證小分子的作用機制,研究者通過電生理實驗證實了在GluN1和GluN2A的連接域處的一對谷氨酸的突變會影響小分子在受體上的作用,進而給小分子在此處的結(jié)合提供了功能驗證。這項工作豐富了NMDA受體的結(jié)構(gòu)和藥理學(xué)研究,完整闡釋了其作為離子通道的門控機制,為藥物設(shè)計、篩選及新藥研發(fā)提供了重要的理論依據(jù)(圖2)。
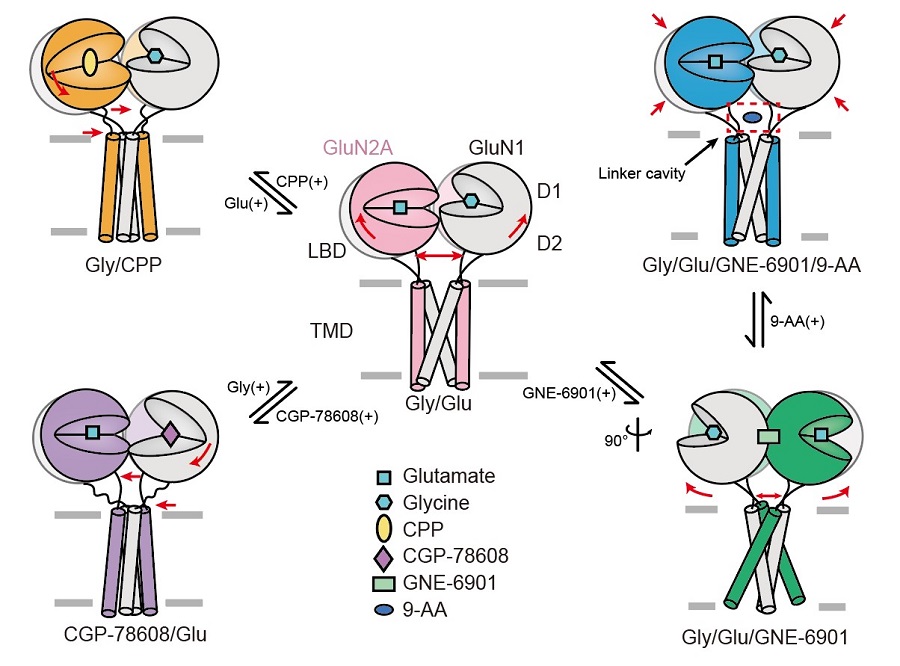
圖2 | GluN1-GluN2A NMDA受體的門控機制
該工作由中國科學(xué)院腦智卓越中心突觸蛋白結(jié)構(gòu)和功能課題組的博士研究生王涵在竺淑佳研究員的指導(dǎo)下完成,實驗室研究生呂詩云,黃雪晶,研究實習(xí)員張金寶,潘祎杰作出重要貢獻。研究內(nèi)容也得到法國巴黎高等師范學(xué)校Pierre Paoletti教授合作指導(dǎo)。中科院腦智卓越中心,浙江大學(xué)、生物物理所及上海科技大學(xué)的冷凍電鏡平臺為本研究的數(shù)據(jù)采集提供大力支持。該研究得到國家自然科學(xué)基金委、科技部、中國科學(xué)院,上海市科委及歐洲研究委員會的資助。

 附件下載:
附件下載: